Wie viele Arzneimittel sind in Deutschland verkehrsfähig? Wie viele klinische Studien werden jährlich registriert? Wie viele Risikomeldungen für Medizinprodukte gehen beim BfArM ein? Dieses Kapitel bildet Daten und Statistiken ab, die beispielhaft für die Arbeit und Vielfalt von Europas größter Behörde im Bereich der Zulassung und Sicherheit von Arzneimitteln und Medizinprodukten stehen.
Das BfArM als Arbeitgeber
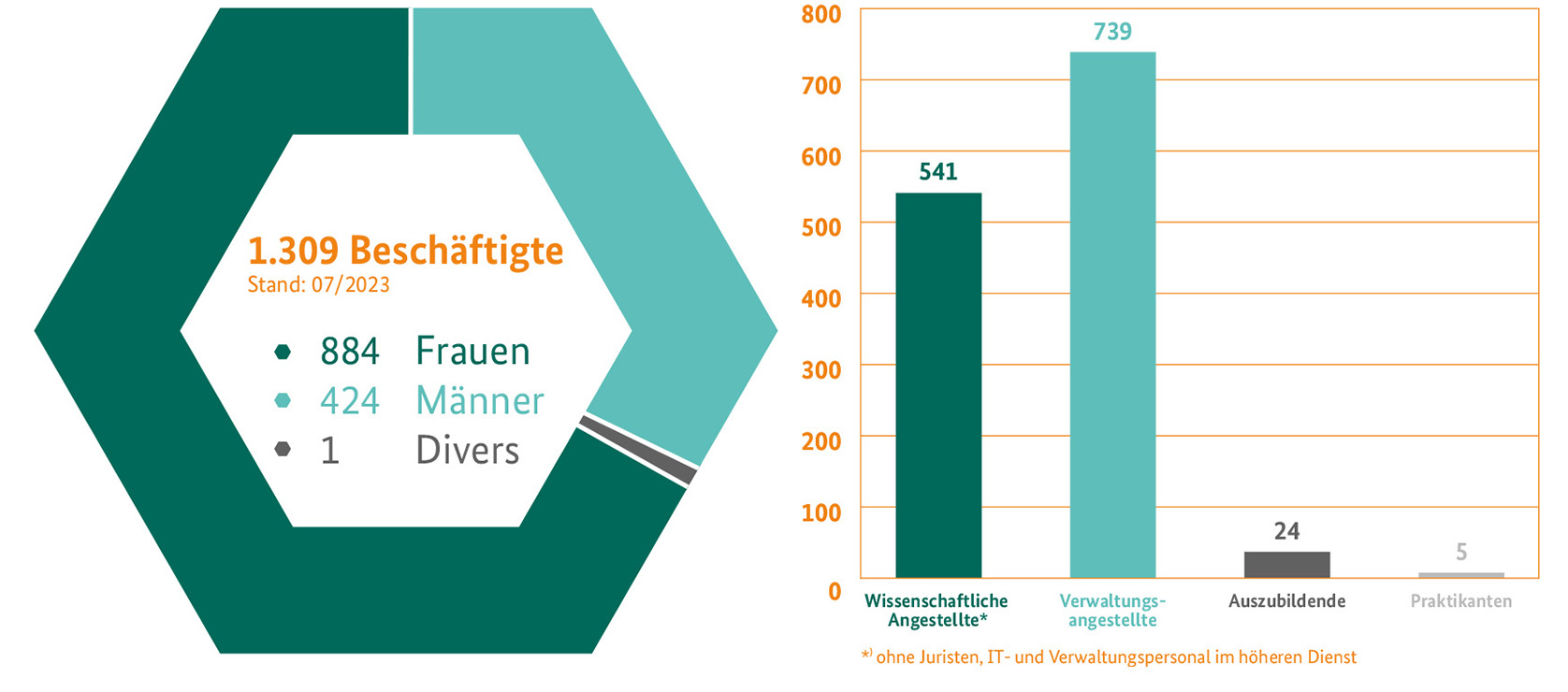
Das BfArM ist die größte europäische Behörde im Bereich der Zulassung und Sicherheit von Arzneimitteln und Medizinprodukten. Rund 1.300 Mitarbeiterinnen und Mitarbeiter unterschiedlichster Fachrichtungen setzen sich hier für die sichere Versorgung der Patientinnen und Patienten ein.
Unter den wissenschaftlichen Angestellten sind rund 31 Prozent Pharmazeutinnen und Pharmazeuten; rund 22 Prozent kommen aus der Ärzteschaft; knapp die Hälfte (rund 47 Prozent) machen naturwissenschaftliche Berufsgruppen aus.
109
Anträge zur Aufnahme ins DiGA-Verzeichnis
... gingen 2021 und 2022 insgesamt beim BfArM ein. 32 Anwendungen wurden nach Prüfung aufgenommen.
210
Beratungen
... zu Digitalen Gesundheitsanwendungen (DiGA) hat das BfArM 2021 und 2022 insgesamt durchgeführt.
290
nationale wissenschaftliche Beratungsverfahren
... hat das BfArM 2022 durchgeführt. Diese können umfassen: Beratung in der Entwicklungsphase, vor Beantragung einer Klinischen Prüfung oder vor Stellung eines Zulassungsantrags.
33
Kick-off-Meetings
... hat das BfArM-Innovationsbüro 2021 und 2022 insgesamt durchgeführt. Akademische Forschungsgruppen, kleine und mittelständische Unternehmen sowie Startups haben hier die Möglichkeit, in der frühen Arzneimittel- und Medizinprodukteentwicklung orientierende Hilfestellung zu erhalten.
Arzneimittelzulassung
Dezentrale Zulassungsverfahren: Federführende Bearbeitung BfArM
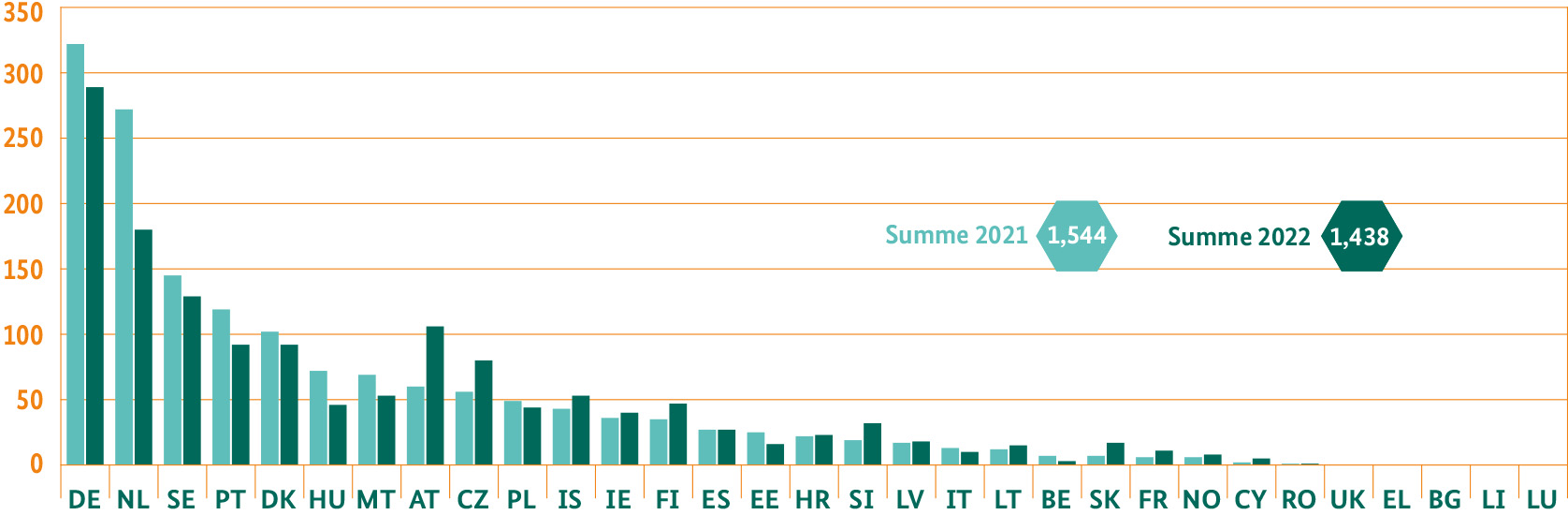
Im europäischen Netzwerk aller Zulassungsbehörden für Arzneimittel hat das BfArM seine führende Position in den vergangenen Jahren bestätigt. Während der Covidpandemie hat das BfArM die Bearbeitung von Verfahren als sogenannter Reference Member State (RMS) trotz vieler zusätzlicher Aufgaben uneingeschränkt aufrechterhalten. Dem RMS obliegt die federführende Bearbeitung. Im Jahr 2021 hat das BfArM 21 Prozent aller dezentral durchgeführten EU-Verfahren als RMS betreut. Darunter fallen sogenannte DCP-Verfahren (Decentralised Procedure) und Verfahren der gegenseitigen Anerkennung (Mutual Recognition Procedure, MRP). Im Jahr 2022 war das BfArM als RMS an 20 Prozent aller dezentral durchgeführten EU-Verfahren beteiligt.
Zentrale Zulassungsverfahren über die Europäische Arzneimittel-Agentur (EMA)
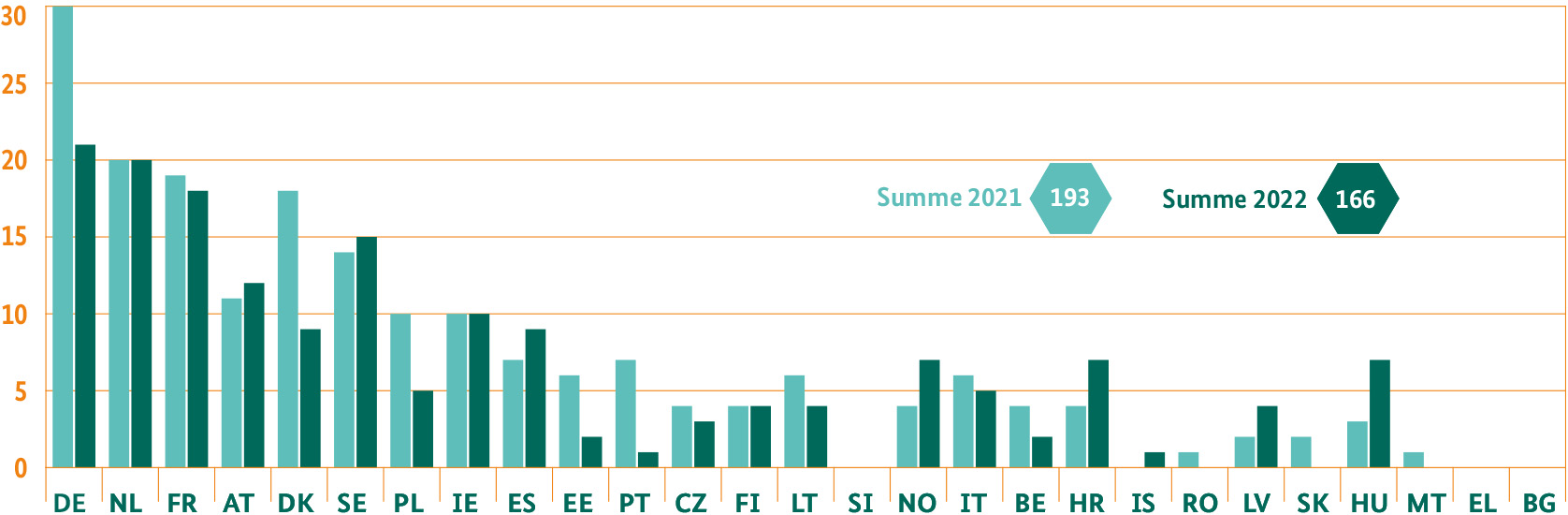
Auch bei den zentralen Zulassungsverfahren für innovative Arzneimittel nimmt das BfArM eine führende Rolle ein. Die Zulassung der betreffenden Arzneimittel gilt bei diesen Verfahren automatisch für den ganzen Europäischen Wirtschaftsraum – im Gegensatz zu den dezentralen Verfahren. Im Jahr 2021 stellte Deutschland für 30 zentrale Verfahren den Rapporteur oder Co-Rapporteur, das heißt die berichterstattende bzw. federführende Behörde (BfArM und Paul-Ehrlich-Institut, PEI). Sowohl 2021 als auch 2022 hatte das BfArM bei 15 Verfahren die Federführung. 2021 unterstützte es zudem das für Impfstoffe zuständige PEI bei Einzelverfahren in der Beurteilung der Qualität der Impfstoffe.
Deutsches Register Klinischer Studien (DRKS)
Durchgeführte Registrierungen pro Jahr
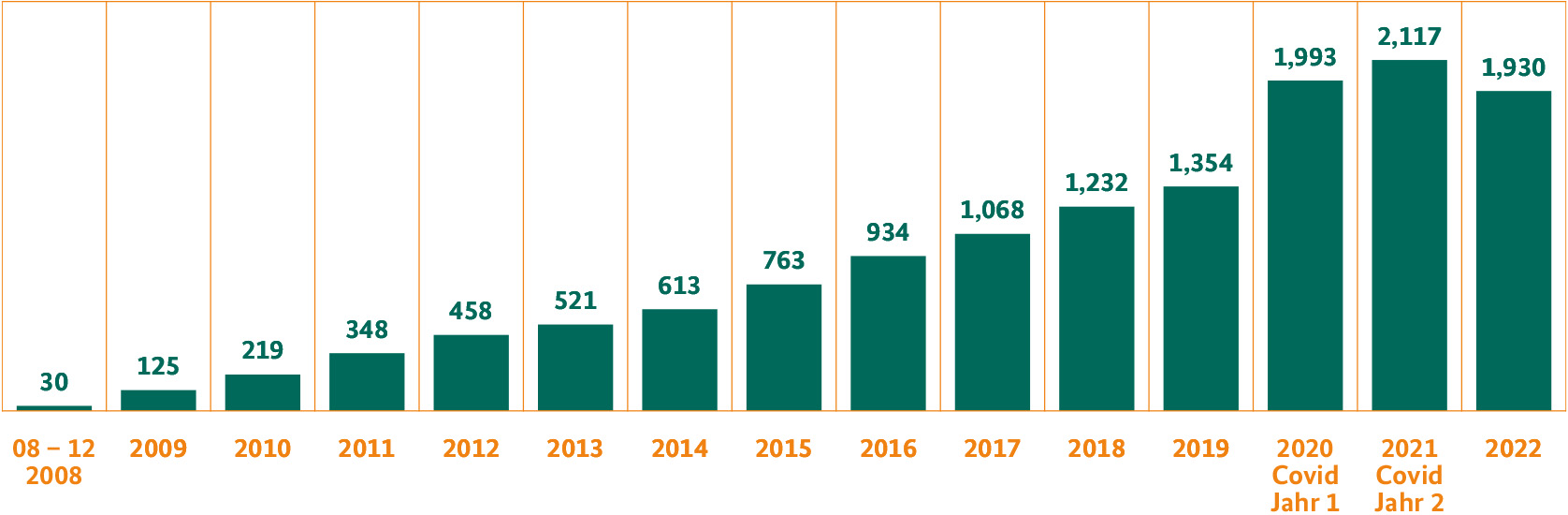
Das Deutsche Register Klinischer Studien (DRKS) ist das von der Weltgesundheitsorganisation WHO anerkannte Primärregister für Deutschland und ist für die Registrierung aller in Deutschland durchgeführten patientenorientierten klinischen Studien zuständig. Ziel ist es, der Öffentlichkeit einen vollständigen, aktuellen Überblick über alle in Deutschland durchgeführten klinischen Studien zu liefern. Das DRKS ist ein unabhängiger Anbieter mit öffentlicher Förderung, der durch das BfArM betrieben wird. Ende 2022 umfasste das Register rund 13.500 Studien und verzeichnet ein konstantes Wachstum. Seit 2016 hat sich die Anzahl der Registrierungen nahezu verdoppelt.
600
Erstanträge
... auf Genehmigung einer klinischen Prüfung hat das BfArM 2022 bearbeitet
12
GCP-Inspektionen
... (Gute Klinische Praxis) hat das BfArM 2021 und 2022 insgesamt durchgeführt.
Nebenwirkungen melden
Direktmeldungen aus Deutschland durch Patientinnen und Patienten
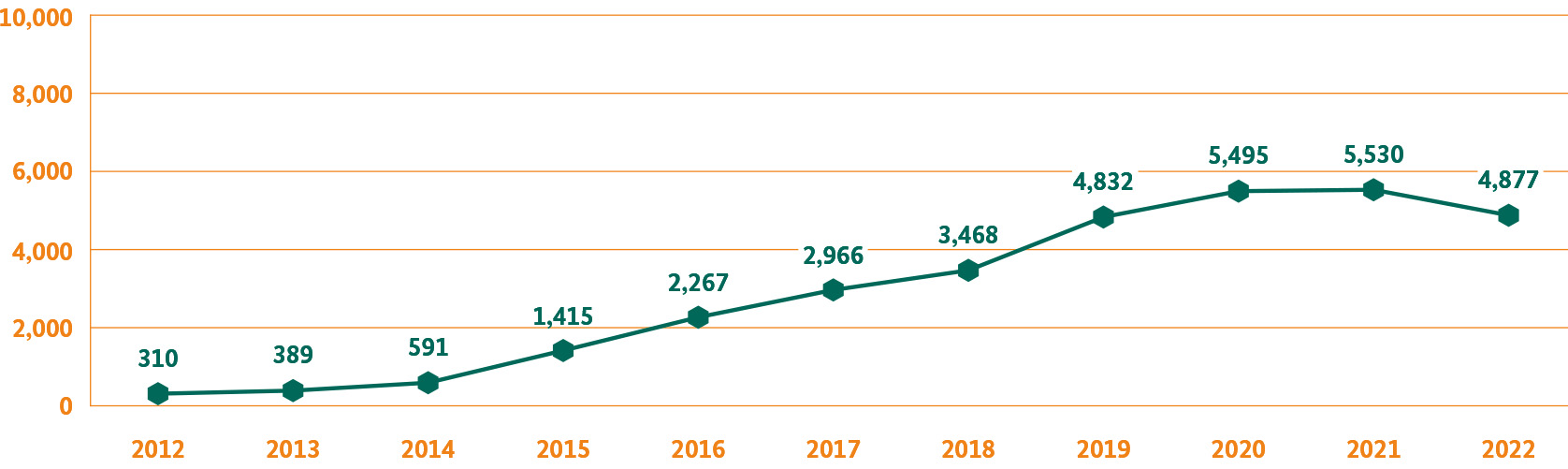
Das BfArM stellt gemeinsam mit dem PEI das Online-Portal www.nebenwirkungen.bund.de zur Verfügung, über das unerwünschte Arzneimittelwirkungen gemeldet werden können. Jede Meldung gelangt von dort aus schnell, direkt und sicher zu den Expertinnen und Experten der beiden Behörden. Wichtig ist: Melden können nicht nur Angehörige der Heilberufe, sondern auch Patientinnen und Patienten sowie deren Angehörige oder Vertretende. Das BfArM selbst verzeichnet seit vielen Jahren einen anhaltenden Trend signifikant steigender Zahlen von Direktmeldungen. Beispielsweise sind die Meldungen durch Patientinnen und Patienten sowie deren Angehörige oder Vertretende in den vergangenen zehn Jahren um das 16-Fache gewachsen.
rund 105.000
verkehrsfähige Arzneimittel
... gibt es in Deutschland im Zuständigkeitsbereich des BfArM (Stand Juli 2023).
288.845
Verdachtsfälle von Nebenwirkungen
... wurden 2022 bei der Europäischen Arzneimittel-Agentur (EMA) aus Deutschland erfasst. Insgesamt gingen 1.193.132 Meldungen bei der EMA ein.
970
Meldungen zu möglichen chargenbezogenen Qualitätsmängeln
... hat das BfArM 2022 insgesamt bearbeitet.
42
Meldungen zu Fälschungsverdachtsfällen
... gingen 2022 über das internationale Schnellwarnsystem ein, die überwiegend außerhalb der legalen Lieferkette entdeckt wurden.
Risikomeldungen für Medizinprodukte
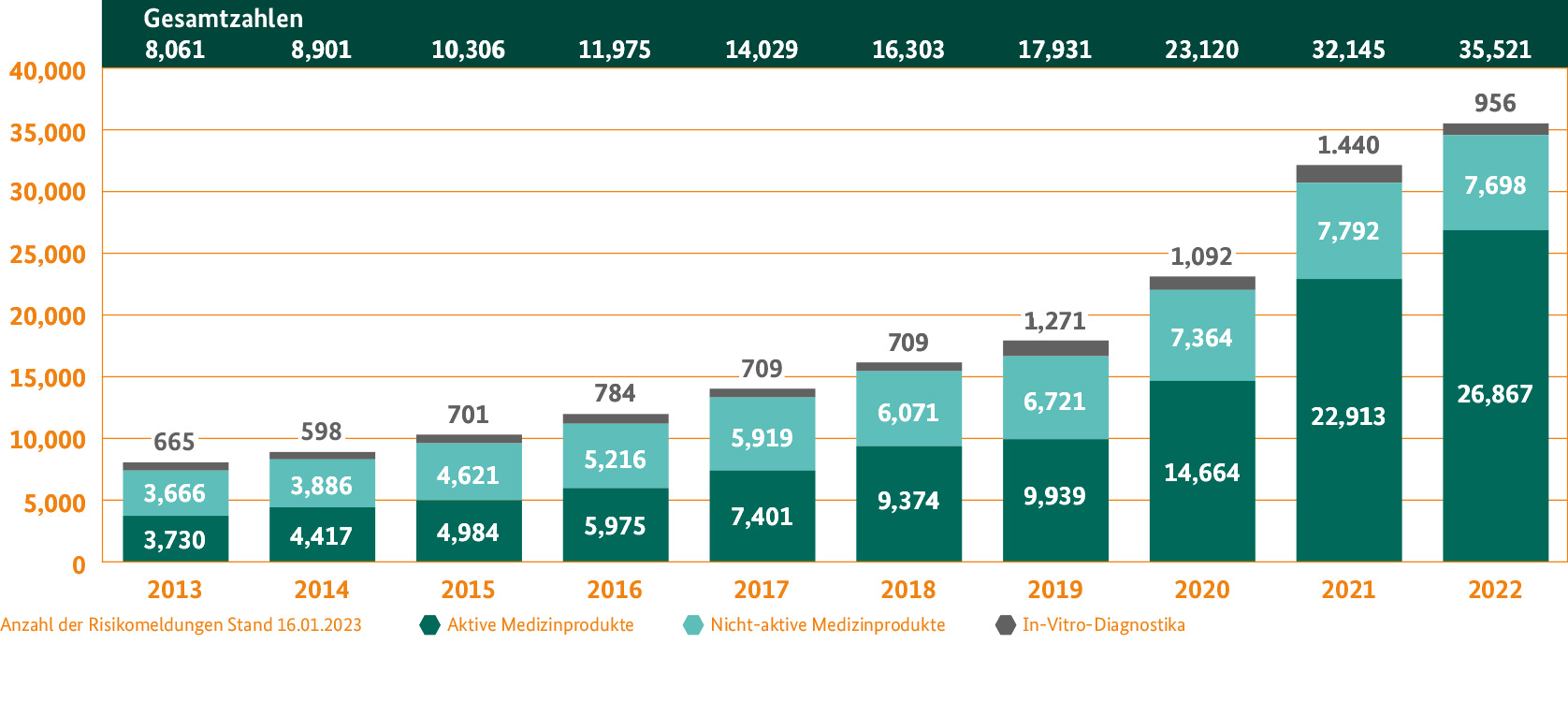
Die Hauptaufgabe des BfArM bei Medizinprodukten ist die Risikobewertung von Vorkommnissen. Hersteller, Bevollmächtigte, Importeure sowie Anwender, Betreiber und sonstige Inverkehrbringer sind nach den Bestimmungen der Medizinprodukte-Sicherheitsplanverordnung (MPSV) verpflichtet, Vorkommnisse mit Medizinprodukten an das BfArM zu melden.
Cannabis-Importe zu medizinischen und wissenschaftlichen Zwecken
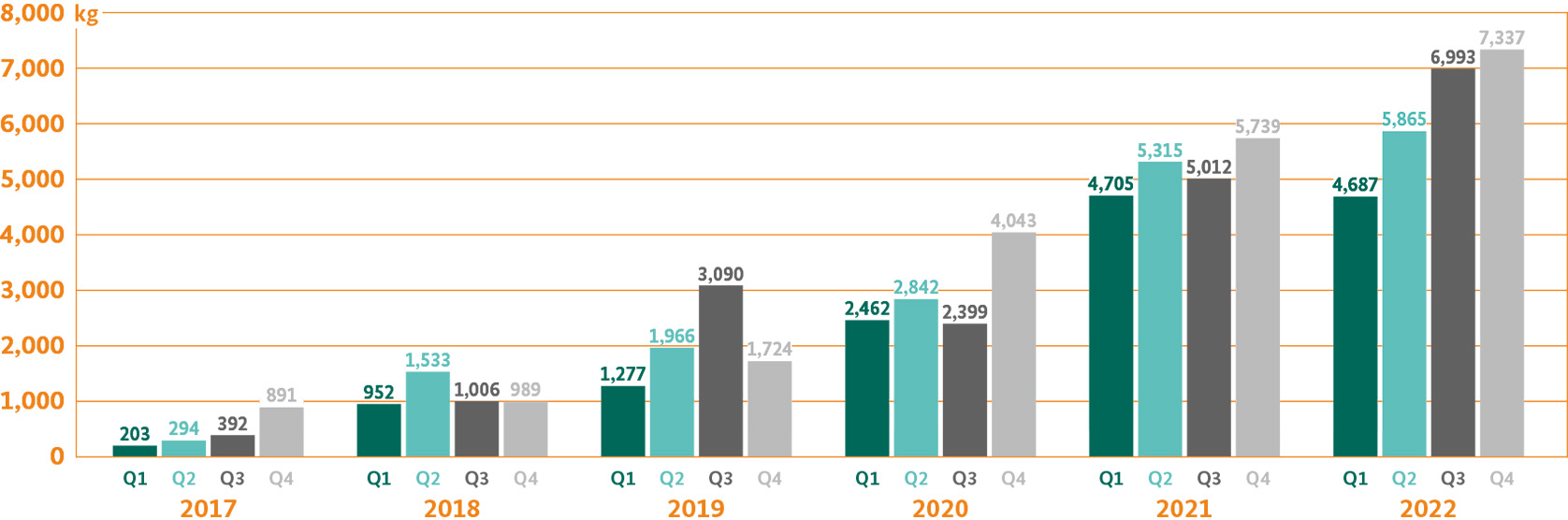
Medizinalcannabis kann grundsätzlich aus jedem Staat importiert werden, der den Anbau von Cannabis zu medizinischen Zwecken unter staatlicher Kontrolle gemäß dem Einheits-Übereinkommen von 1961 über Suchtstoffe durchführt und Cannabis in Arzneimittelqualität anbieten kann. Die Bundesopiumstelle des BfArM erteilt den am Import von Medizinalcannabis interessierten Unternehmen die erforderlichen Erlaubnisse und Genehmigungen, hat darüber hinaus aber keine zentrale Steuerungsfunktion. Ebenfalls hat sie keinen Einfluss darauf, ob und in welchem Umfang die berechtigten Unternehmen Cannabis tatsächlich importieren.
15,7 Mio.
Betäubungsmittel-Rezepte
... hat das BfArM 2022 an Ärztinnen und Ärzte ausgegeben. Tendenz weiter leicht steigend.
788
Hektar
... betrug die Anbaufläche für Schlafmohn (Papaver somniferum) im Jahr 2022. Erstmals ein Rückgang, nachdem die jährliche Anbaufläche 2021 mit 1.077 Hektar einen Höchstwert erreicht hatte.










